입력 : 2018-05-30 11:30:10
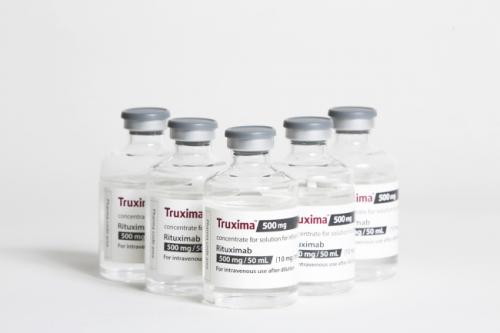
셀트리온은 미국 FDA에 혈액암 치료용 항체 바이오시밀러 '트룩시마(CT-P10)' 허가를 위한 추가 보완자료를 제출했으며 FDA의 허가 심사가 재개된다고 30일 밝혔다. 또한 허쥬마(CT-P6)의 허가를 위한 추가 보완자료도 다음달 제출할 계획이다.
FDA 규정에 따르면 추가 보완서류 접수 후 통상 6개월 이내에 허가 심사를 마무리하게 된다.
셀트리온은 지난해 4월과 5월 FDA에 트룩시마와 허쥬마의 바이오의약품 품목허가를 각각 신청해 심사 과정을 거쳐왔다. 그러나 최근 FDA로부터 두 제품의 허가와 관련 지난해 5월 실시된 FDA 정기실사 결과와 연관돼 최종 보완요구 공문(CRL)을 받은 바 있다.
앞서 셀트리온은 우수 의약품제조품질관리기준(cGMP) 관련 후속 조치를 마무리 짓기 위해 외부 컨설팅 기관과 더불어 지속적으로 FDA와 긴밀하게 협의해 왔다. 정기감사 지적 사항에 대한 후속 조치를 이행하는 동시에 두 제품의 허가 프로세스를 재개하기 위함이다.
트룩시마와 허쥬마 두 제품이 FDA 판매 허가를 획득하게 되면 셀트리온은 화이자를 통해 미국에서 판매 중인 램시마(인플렉트라)에 이어 총 세 개의 항체 바이오의약품을 미국에 선보이는 최초 기업이 된다. 트룩시마와 허쥬마는 미국 내 독점 판매 계약을 체결한 글로벌 제약사 테바를 통해 현지 특허 상황을 고려해 미국 시장에 선보인다는 계획이다.
램시마와 트룩시마, 허쥬마 세 제품의 오리지널의약품 시장규모는 약 23조원이고 이 중 미국 시장 규모가 약13조원으로 절반 이상을 차지하고 있다.
셀트리온 관계자는 “미국 항암제 시장에서도 트룩시마와 허쥬마가 보다 합리적인 가격으로 더 많은 암환자들에게 항암 항체 바이오시밀러의 혜택을 누릴 수 있도록 판매 허가 획득과 상업 론칭까지 최선을 다하겠다”고 말했다.
베타뉴스 이동희 기자 (press@betanews.net)
Copyrights ⓒ BetaNews.net
-
 목록
목록-
 위로
위로